Mammacarcinoom
Mammacarcinoom
Bijna alle (>95%) mamma maligniteiten zijn adenocarcinomen die beginnen als carcinomen in situ uit het ductus-lobulair systeem. Wanneer mammacarcinoom wordt gedetecteerd zal bij 70% van de gevallen het basaalmembraan doorgebroken zijn en het stroma geïnvadeerd.
Carcinoma in situ betekent dat het epitheliale neoplasma beperkt blijft binnen de anatomische ruimte van ducti en lobulen door het basaalmembraan. Invasieve carcinoma heeft het basaalmembraan gepenetreerd en groeit door tot de stroma.
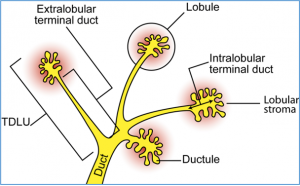
Bijna alle mammacarcinomen ontstaan in de terminal ductal lobular unit (TDLU, zie hieronder). Wanneer de carcinoma is ontstaan in de duct (melkgang) spreken we van DCIS: ductaal carcinoma in situ; en wanneer de carcinoma is ontstaan in de lobule (melkklier)spreken we van LCIS: lobulair carcinoma in situ. De DCIS wordt bijna altijd geïdentificeerd door mammografie, vanwege calcificaties die optreden. Mammografie in het kader van het bevolkingsonderzoek wordt iedere 2 jaar aangeboden aan vrouwen tussen de leeftijd 50 en 75 jaar.
Net als andere kankersoorten, ondergaan mammacarcinomen meerdere genetische afwijkingen, onder invloed van hormonen en hereditaire susceptibility gen(en). De mammacarcinoom kan zijn:
- Hereditair: wanneer er mutaties zijn in tumor supressor genen in de kiemlijn
- Sporadisch: wanneer kanker (mammacaricnoom in dit geval) optreedt zonder aanwezigheid van familiaire voorgeschiedenis of hereditaire susceptibilty genen.
Familiaire mammacarcinoom
Dit betreft 12% van de mammacarcinomen, die dus ontstaan vanwege erfelijke susceptibility gen(en). De waarschijnlijkheid van een hereditaire mammacarcinoom stijgt bij:
- Bilaterale mammacarcinoom
- Aangedane eerstegraadsfamilieleden
- Vroege onset
- Familieleden met andere kankersoorten
De hoofdzakelijke susceptibility genen voor familaire borstkanker zijn allemaal tumor suppressor genen: BRCA1, BRCA2, TP53 (Li-Fraumeni syndroom) en CHEK2.
Mutaties in BRCA1 en BRCA2 zijn verantwoordelijk voor 80-90% van de single-gene familiaire borstkanker en 3% van het totale aantal borstkankers.
- Penetrantie (% van dragers die werkelijke mammacarcinoom ontwikkelen) bedraagt 30-90%.
- BRCA-mutaties worden dominant overgeërfd, hoewel slechts 1 allel dominant overgeërfd wordt (zie afbeelding).
- Aangezien tumor suppressor genen uit 2 allelen bestaan, is er slechts 1 sporadische BRCA-mutatie nodig in het overgebleven, gezonde allel om tumor suppressor functie te verliezen (two-hit model).
- BRCA1- en BRCA2-dragers hebben tevens vergrote kans op ovariacarcinoom 20-40% en 10-20% penetrantie, respectievelijk.
- Ook vergrote kans op andere carcinomen: bv. prostaat- of pancreascarcinoom.
- BRCA1 bevindt zich op chromosoom 17 en BRCA2 op chromosoom 13.
Sporadische mammacarcinoom
Grootste risicofactoren hiervoor zijn gerelateerd aan hormonen: geslacht, leeftijd van menarche en menopauze, reproductieve voorgeschiedenis, borstvoeding en exogene oestrogenen.
Oestrogeen bevordert de ontwikkeling tot mammacarcinoom. Het stimuleert borstgroei tijdens:
- Puberteit
- Menstruatiecyclus
- Zwangerschap
Hierdoor is de potentie om tot kanker te ontwikkelen groter. Plus, de periodieke stimulatie tijdens menstruatie zou ook de kans groter maken voor accumulatie van defectief DNA. Dat verklaart dan ook waarom het cumulatieve aantal menstruatiecycli een risicofactor is voor mammacarcinoom.
Wederom betreft de kanker een stamcel: de residente stamcellen van het mammaweefsel. Zodra er oncogenetische mutaties hebben opgetreden zijn er 3 hoofdzakelijke pathways van carcinogenese, waarbij ER staat voor oestrogeen-receptor:
- ER-positieve, HER2-negatieve kanker (50-65%)
- Ontstaan via de dominante pathway.
- Betreft vaak kiemlijnmutaties in
- HER2-positieve kanker (10-20%)
- Ontstaan via een pathway met amplificatie van HER2-genen op chromosoom 17.
- Kunnen zowel ER-positief als ER-negatief zijn.
- Betreft vaak kiemlijnmutaties in TP53 (Li-Fraumeni syndroom).
- ER-negatieve, HER2-negatieve kanker (10-20%)
- Ontstaan via pathways die onafhankelijk zijn van zowel ER-gemedieerde veranderingen in genexpressie als HER2-genamplificaties.
- Minst begrepen pathway van de 3.
- Betreft vaak kiemlijnmutaties in
Chirurgische therapie
Gemodificeerde radicale mastectomie (ablatio mammae)
- Chirurgische verwijdering van de mamma samen met de fascie m. pectoralis major, in combinatie met biopsie van ‘sentinel node’ poortwachtersklier. Indien negatief dan hoeft er geen okselkliertoilet plaats te vinden.
- Bij grotere tumoren en/of een kleine mamma is een gemodificeerde radicale mastectomie aangewezen.
Mammasparend: lumpectomie
- In combinatie met sentinel-node-procedure en/of okselkliertoilet, gevolgd door radiotherapie.
- Voor kleine tumoren is (< 5 cm) is de twintigjaarsoverleving equivalent aan ablatio mammae. Bij jongeren is de kans op lokaal recidief echter aanwezig.
Straling
- Locoregionale bestraling zal plaatsvinden bij (het vermoeden van) een niet-radicaal okselkliertoilet. De meningen zijn verdeeld over het nut van bestraling bij kapseldoorbraak of bij een positieve okselkliertop.
- Thoraxwand bestraling na ablatio mammae is vereist indien de resectie niet radicaal blijkt te zijn (krap of niet-tumorvrij sneevlak, mutlifocale tumoren en/of lymfevaatingroei).
Adjuvante therapie
Kan bestaan uit chemotherapie en/of hormonale therapie. De keuze voor een algemene systemische therapie (hormonaal, chemotherapie, trastuzumab, evt. gecombineerd met pijnbestrijding) is afhankelijk van: leeftijd, conditie, hormoon- en HER2-receptorstatus van primaire tumor, het ziektevrije interval, snelheid van tumorprogressie, lokalisatie van metastasen en ernst van de klachten.
- Bij langzame progressie: beginnen met hormonale therapie.
- Bij snelle progressie, met kort ziektevrij interval: beginnen met chemotherapie. Helemaal indien ER-. Aangezien de kans op respons dan groter is.
- Bij HER2-positieve tumoren met indicatie voor chemotherapie wordt ook trastuzumab (Herceptin) gegeven.
- Bij postmenopauzale vrouwen wordt tamoxifen gevolgd door aromataseremmers.
- Sterftereductie van adjuvante therapie met tamoxifen is 25%, bij zowel okselklierpositieve als -negatieve patiënten.
- Indien hormoonreceptor status positief is, wordt na chemotherapie alsnog tamoxifen gegeven.
- Bij vrouwen jonger dan 50 jaar heeft adjuvante chemotherapie een vergelijkbaar effect als adjuvante tamoxifen.
Hormonale therapie
Aromataseremmers
- Het enzym aromatase kan (de door bijnier geproduceerde) androgenen (zoals testosteron en androsteendion) omzetten in oestrogenen (resp. oestradiol en oestron). Deze omzetting vindt plaats in alle perifere weefsels, incl. mammaweefsel. Aromatase bevindt zich in 60-70% van alle mammacarcinomen.
- Eerste keus bij behandeling van gemetastaseerd mammacarcinoom. Ze hebben de voorkeur t.o.v. tamoxifen omdat deze een verhoogd risico geven op trombo-embolische complicaties en endometriumcarcinoom.
- Heeft de voorkeur bij postmenopauzale vrouwen.
- Bij ER+ is de kans op respons of stabiele ziekte na eerste hormonale behandeling 60%, met een mediane responsduur van 12-15 maanden. 3 jaar behandelen.
- Bijwerkingen volgen vnl. uit de verlaagde oestrogeenspiegels door het medicijn.
Tamoxifen
- Anti-oestrogene werking op mammaweefsel; zwak-oestrogeen effect op endometrium (verhoogde kans op endometriumcarcinoom), bot (bij postmenopauzale vrouwen; remming botresorptie), op hypofyse en bloedlipiden (daling totaal- en LDL-cholesterol).
- Precieze mechanisme is onbekend, maar waarschijnlijk directe binding met oestrogeenreceptor en daardoor verstoorde RNA-transscriptie en verminderde celproliferatie.
- Bij premenopauzale patiënten moet een LHRH-analoog (gosereline) worden toegevoegd en is tamoxifen eerste keus. Toevoeging van LHRH-analoog maakt de behandeling van tamoxifen effectiever dan enkel tamoxifen.
- Bij ER+ is de kans op respons 20-30%. 5 jaar behandelen.
- Alleen effectief als de hormoonreceptoren positief zijn.
- Bijwerkingen: verhoogde kans op trombo-embolische complicaties en endometriumcarcinoom.
Progestativa (progestagenen) (bv. megestrol)
- Synthetische progestatieve stof met een duidelijke anti-oestrogene activiteit.
- Worden doorgaans gebruikt als derdelijns hormonale therapie, m.n. postmenopauzaal.
- Bijwerkingen: sterke gewichtstoename, Cushing-syndroom en virilisatie. Wordt in de praktijk doorgaans goed verdragen.
Corticosteroïden
- Worden gereserveerd voor enkele specifieke indicaties zoals: hersenmetastasen, lymfangitis en levermetastasen in terminale fase.
- Bij hersenmetastasen geven ze vooral een subjectieve verbetering, waarbij een gunstige reactie nogal eens indicatief is voor een goede respons op nog te geven radiotherapie.
Chemotherapie
- Combinatiechemotherapie blijkt effectiever dan enkelvoudige cytostatica (celgroeiremmende middelen).
- Bij metastasen wordt een respons bereikt bij 50-60%, in een mediane responsduur van 10-12 maanden.
- Doxorubicine(=adriamycine)-bevattende combinaties zijn effectiever dan niet-doxorubinicinebevattende combinaties, maar ook toxischer.
- Bij resistentie tegen doxorubicinebevattende combinatie kan men taxoïd overwegen.
- Omdat het een palliatieve behandeling betreft (en progressie vroeger of later optreedt; ook als complete respons wordt bereikt; genezing van gemetastaseerde carcinoom is uitzonderlijk) moet men zich bewust zijn van de therapeutische breedte van chemotherapie en waken voor al te toxische behandelingen; onderdosering moet echter ook voorkomen worden.
- Gelijktijdige hormonale en cytostatische therapieën klinkt in theorie aantrekkelijk, is niet superieur gebleken. Sequentiële therapie heeft de voorkeur.
Prognose
- Afhankelijk van de grootte van primaire tumor, aantal positieve okselklieren en de hormoonreceptorstatus.
- Tienjaarsoverleving:
- Van patiënten zonder okselkliermetastasen is 70-80%.
- Van patiënten met meer dan 10 positieve okselklieren is de kans op recidief groot, 70-80%. Een recidief presenteert zich meestal als hematogene metastasen.
