Angina pectoris en het acuut coronair syndroom
Angina pectoris en het acuut coronair syndroom
Auteur: drs. A. (Ali) Talib, arts-assistent Cardiologie
Datum van publicatie: 1 november 2020
Laatst gewijzigd: 1 november 2020
- Thoracale pijnklachten: pijn op de borst, ongeacht de oorzaak
- Angina pectoris (AP): pijn op de borst als gevolg van myocardischemie. Dit kan zowel stabiel zijn, als acuut ontstaan en/of verergeren, zoals bij een acuut coronair syndroom (dus IAP/NSTEMI/STEMI).
- Instabiele angina pectoris (IAP), ook wel crescendo angina pectoris: dit is een klinische diagnose; het betreft AP die progressief is qua frequentie, duur, intensiteit en/of hoe goed de klachten afnemen na toediening van nitroglycerine. Per definitie is er geen sprake van infarcering (dus geen troponinestijging), dus de ischemie is niet zodanig ernstig/langdurig dat er weefsel afsterft.
- Non-ST-elevatie myocardinfarct (NSTEMI): een hartinfarct (dus verhoogde en dynamische troponines), waarbij er geen ST-segmentelevaties op het ECG te zien zijn. Soms is het ECG volstrekt normaal. Het uitblijven van ST-segmentelevaties impliceert dat er nog geen transmurale ischemie is (dus geen ischemie over de gehele hartspierwand).
- ST-elevatie myocardinfarct (STEMI):een hartinfarct, waarbij er ST-segmentelevaties te zien zijn, dus met transmurale ischemie.
- Acuut coronairsyndroom (ACS):een verzamelnaam voor acute ischemische pathologie als gevolg van coronairobstructie, dus IAP, NSTEMI en STEMI. De meeste gevallen van ACS komen door een scheur van een atheromateuze plaque, waardoor het onderliggende vet, kalk en collageen (dat trombogeen is) blootgesteld wordt en er snel een volledige occlusie ontstaat door trombusvorming ter plaatse, en/of door distale embolisatie van het afgescheurde fragment.
- Troponinedynamiek: dit wil zeggen dat je ≥ 2 troponinewaardes hebt, waarvan er ten minste één verhoogd is en de andere waarde(n) een stijging en/of daling laten zien (dynamiek). Dit wordt ook wel een ‘significante rise or fall’ genoemd en is een biochemische voorwaarde om te kunnen spreken van een infarct. Let wel: troponinedynamiek is dus geen voorwaarde om te kunnen spreken van IAP, want IAP is een klinische diagnose, gebaseerd op een hoge priorkans en een typische anamnese voor acute of progressieve angina pectoris, waarbij er per definitie geen troponinedynamiek is.
- Myocardial Infarction with No Obstruction of Coronary Arteries (MINOCA): een acuut coronairsyndroom, waarbij een coronairangiogram geen verklarend coronairlijden laat zien. Dit kan een breed aantal oorzaken hebben.
Een acuut coronair syndroom (ACS) kan theoretisch gezien op alle leeftijden voorkomen, afhankelijk van de etiologie. Zo kan een spontane coronairdissectie of een coronairspasme al op jonge leeftijd leiden tot een acute obstructie en daardoor een ACS.
Echter, verreweg de meest voorkomende oorzaak van AP en ACS is atherosclerose. Terwijl het atheroscleroseproces al op jongvolwassen leeftijd begint, ontstaat klinisch manifest coronairlijden meestal pas vanaf een leeftijd van circa 50 of 60 jaar. Risicofactoren voor coronairlijden zijn dezelfde als voor atherosclerose in het algemeen: mannelijk geslacht, roken en een sedentaire leefstijl. Patiënten met perifeer vaatlijden en diabetes mellitus type 2 hebben ook een aanzienlijk verhoogd risico op coronairlijden. Hoewel het mannelijk geslacht een risicofactor is voor coronairlijden, komt het ook vaak voor bij vrouwen. ACS zonder obstructief coronairlijden (MINOCA) komt juist meer voor bij vrouwen dan bij mannen.
De ernst van een coronairobstructie wordt meestal uitgedrukt in percentage van het oppervlak dat verstopt is, waarbij een stenose van 70% of hoger als significant wordt geduid. Een ‘stabiele’ plaque/stenose hoeft, ook als die significant is, niet per se acute pathologie te veroorzaken. Zo krijgt een patiënt met een stabiele plaque soms op voorspelbare wijze AP bij (forse) inspanning, doordat de myocardperfusie dan tekortschiet. Er is dan sprake van stabiele AP.
Bij een ACS is er per definitie een acuut moment, dus een plotse coronairocclusie. In de meeste gevallen is dit het gevolg van ruptuur van het kapsel van een atherosclerotische plaque die vaak al decennia langzaam groeit. Zo’n scheur ontstaat doorgaans spontaan, door turbulentie van het langsstromende bloed. Normaliter beschermt het endotheel van een bloedvat tegen stolselvorming, doordat er heparine op het endotheel ligt (de glycocalyx). Nu de plaque is gescheurd, is er geen beschermende endotheellaag meer en is het (sterk trombogene) onderliggende vet en kalk nu blootgesteld aan het bloed. Dit leidt tot de vorming van een stolsel, waardoor het vat afsluit. Nu is er een acute afsluiting en ondervindt de hartspier distaal van de vernauwing zuurstoftekort.
Wanneer je anamnese voert bij een patiënt met pijn op de borst, zal dit vaak in een (semi)acute setting zijn, bijvoorbeeld op een eersteharthulp. In je anamnese zijn dan de volgende zaken van belang:
- Hoe lang heeft de patiënt al klachten?
- Is de patiënt nu klachtenvrij?
- Betreft het ‘typische’ AP, of zijn dit minder specifieke thoracale klachten?
- Zijn er aanwijzingen voor andere oorzaken?
Hoe lang heeft de patiënt al klachten?
Deze vraag heeft op meerdere manieren toegevoegde waarde. Ten eerste zijn de hartenzymen (bijv. troponine T) doorgaans laag als iemand zich zeer snel na aanvang van de klachten presenteert. Als bloed is afgenomen binnen 1 uur na starten van de klachten, dan is dit ‘niet-representatief’ en moet er bij verdenking op ACS een tweede portie troponines worden bepaald. Ten tweede geeft de klachtenduur je waardevolle diagnostische informatie. Als iemand zeer lang ononderbroken klachten heeft (zeker als het langer dan 24 uur is), pleit dit sterk tegen een ACS, zeker als de hartenzymen ondanks de lange klachtenduur laag zijn.
Is de patiënt nu klachtenvrij?
Het antwoord op deze vraag heeft belangrijke therapeutische implicaties. Een klachtenvrije patiënt met een IAP of NSTEMI kan opgenomen worden op een reguliere verpleegafdeling, in afwachting op een hartkatheterisatie. Is de patiënt daarentegen niet klachtenvrij te krijgen, ondanks herhaaldelijk nitroglycerine sublinguaal, dan is dit een indicatie voor opname op de CCU voor toediening van intraveneus nitroglycerine. Als een patiënt met een ACS zelfs met intraveneus nitroglycerine niet klachtenvrij te krijgen is, of als de bloeddruk te laag is om nitroglycerine te geven, dan moet er een spoed-katheterisatie worden overwogen.
Betreft het ‘typische’ AP?
Een vuistregel bij AP is als volgt: een typische anamnese maakt AP waarschijnlijker, echter een atypische anamnese sluit een AP niet uit. Typische kenmerken zijn de volgende:
- Het betreft een drukkend gevoel op de borst
- Er is uitstraling naar de kaken, schouderbladen of armen
- De klachten treden aanvalsgewijs op en de aanvallen duren minuten tot uren
- Bij inspanning verergeren de klachten
- Nitroglycerine verbetert de klachten
Let dus wel: sommige patiënten zullen geen van deze typische kenmerken duiden en toch een ACS hebben. Zeker bij oudere patiënten, patiënten met type 2 diabetes en vrouwen is de klachtenpresentatie vaak atypisch. Dat maakt anamnese een zeer onbetrouwbaar medium om een ACS uit te sluiten.
Zijn er aanwijzingen voor andere oorzaken?
Je moet ook denken aan:
- Longembolie; zitten de klachten vast aan de ademhaling? Is er een dik/rood been geweest? Risicofactoren voor longembolie?
- Aortadissectie; is er sprake geweest van een scheurende pijn? Is er een links- rechtsverschil in de bloeddruk?
- Pneumonie; soms kan een pneumonie zich uiten als thoracale pijn. Heeft de patiënt hoest?
- Musculotendinogene oorzaak; heeft de patiënt recent een ongewone inspanning geleverd?
- Gastrointestinaal; zijn de klachten gerelateerd aan het nuttigen van ‘vettige’ maaltijden?
Het lichamelijk onderzoek is van beperkte waarde in het waarschijnlijker maken van een ACS. Wel is het van belang dat de controles van de patiënt beoordeeld worden (is die hemodynamisch stabiel, satureert de patiënt goed?). Verder kan bij het lichamelijk onderzoek geluisterd worden of er sprake is van kleplijden (een ernstige aortaklepstenose kan bijdragen aan myocardischemie), of er sprake is van afwijkende longgeluiden die kunnen passen bij decompensatie of pneumonie en of de patiënt perifere oedemen heeft. Decompensatio cordis is geassocieerd met een minder gunstige prognose bij ACS.
Bovendien kunnen andere oorzaken van thoracale pijn met je lichamelijk onderzoek meer of minder waarschijnlijk gemaakt worden. Zo kun je beoordelen of de pijn thoracaal drukopwekbaar is. Dit pleit voor een musculotendinogene oorzaak (ook wel syndroom van Tietze). Soms is de pijn in epigastrio drukopwekbaar. Dit pleit meer voor een gastrointestinaal probleem, zoals een gastritis.
Als onderdeel van het lichamelijk onderzoek valt het soms te overwegen de patiënt een antacidum toe te dienen, zoals antagel. Verlichting van de klachten middels antagel levert waardevolle diagnostische informatie.
Het ECG is vaak het eerste ‘objectieve’ onderzoek dat je te zien krijgt bij een patiënt met pijn op de borst. Het ECG is in veel gevallen volstrekt normaal, ook bij het ACS. Een normaal ECG sluit dus geenszins uit dat er sprake is van een ACS.
De waarde van het ECG is als volgt:
- Primair wil je uitsluiten dat er ST-segmentelevaties zijn; dan moet er namelijk zo snel mogelijk overlegd worden met een interventiecardioloog over een spoed-interventie.
- Secundair wil je het ECG in zijn geheel systematisch beoordelen (zie ook het leerartikel ‘Hoe interpreteer je een ECG‘). Een eventuele ritmestoornis kan veroorzaakt worden door de ischemie (bijvoorbeeld een ventrikeltachycardie), of juist ischemie veroorzaken (bijvoorbeeld boezemfibrilleren met een snelle ventrikelvolgfrequentie). In bepaalde gevallen is de enige manifestatie van een infarct een nieuwe geleidingsstoornis, zoals een linkerbundeltakblok. Soms zie je pathologische Q-golven, die erop wijzen dat een patiënt eerder al eens een infarct heeft doorgemaakt, of dat de patiënt zich pas laat presenteert met het infarct, zodat er al ‘dood’ weefsel is ontstaan.
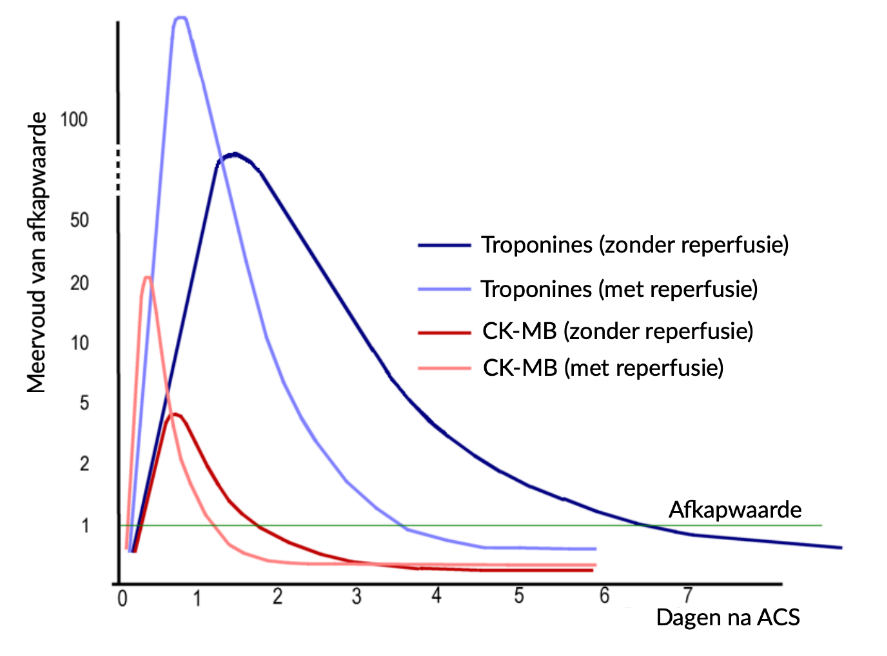
De hartenzymen zijn bij het diagnosticeren van een NSTEMI écht de sleutel. Je hebt biochemisch een infarct (dus NSTEMI) bevestigd als er troponinedynamiek is. Dat wil zeggen dat je ≥ 2 troponines hebt, waarvan er ten minste één verhoogd is en de andere waarde(n) een stijging en/of daling laten zien (dat wil zeggen: dynamiek). Dit wordt ook wel een ‘rise or fall’ genoemd.
Gezien de noodzaak voor acute interventie bij een STEMI, wordt deze diagnose meestal op basis van anamnese, lichamelijk onderzoek en ECG al gesteld, zonder dat er gewacht wordt op troponine-uitslagen. Echter, ook bij een STEMI is er sprake van een infarct en dus troponinedynamiek.
Zijn de troponines laag en veranderen ze niet, dan is er geen infarct en is dus een NSTEMI (of STEMI) uitgesloten. Er kan dan nog steeds sprake zijn van een ACS: bij IAP is er namelijk per definitie louter ischemie, dus zonder infarcering. De diagnose IAP wordt dus gesteld puur op basis van een typische anamnese, eventuele ECG-afwijkingen en het uitsluiten van andere verklaring.
Scenario’s
- STEMI: zo snel mogelijk overleggen met een interventiecardioloog, zodat er een spoedkatheterisatie kan worden verricht.
- IAP of NSTEMI: starten met big five medicatie (zie hieronder). In de meeste gevallen wordt de patiënt opgenomen en wordt er klinisch een hartkatheterisatie verricht. In aanloop naar de katheterisatie wordt dan ook antistolling gegeven (bijvoorbeeld eenmaaldaags fondaparinux subcutaan).
- Dubieus (twijfel over IAP of andere oorzaak): bij twijfel over of er sprake is van AP, kunnen de volgende vervolgonderzoeken worden toegepast:
- Fietsergometrie: hierbij laat je (eventueel poliklinisch) de patiënt inspanning leveren op een fiets, terwijl er een 12-afleidingen-ECG wordt geregistreerd. Zijn er aanwijzingen voor ischemie, dan kan gestart worden met medicatie en kan een hartkatheterisatie worden overwogen.
- CT-calciumscore: bij dit onderzoek verricht je een CT, waarbij beoordeeld wordt hoeveel calcium er in de coronairen zit. Voordeel van dit onderzoek is dat een calciumscore van 0 coronairlijden uitsluit en dat het dus nuttig is bij patiënten met een lage verdenking op coronairlijden. Nadeel is dat een calciumscore van > 0 geen coronairlijden bewijst, maar het ook niet uitsluit. Heb je dus een hoge verdenking op enige mate van coronairverkalking (bijvoorbeeld bij een patiënt die al 60 jaar oud is), dan zal een CT-calciumscore je weinig helpen en valt ergometrie of nucleair onderzoek meer te overwegen.
- Nucleair onderzoek (MIBI-scan/myocardperfusiescintigrafie): middels nucleair onderzoek met een isotoop (technetium-MIBI) worden perfusiedefecten in het myocard blootgelegd.
Big five medicatie bij ACS
- Eerste bloedverdunner (meestal acetylsalicylzuur): wordt levenslang gebruikt als secundaire preventie tegen trombotische events, ook bij stabiele AP
- Tweede bloedverdunner (meestal ticagrelor): wordt na een ACS tijdelijk gegeven naast de eerste bloedverdunner, om de relatief kwetsbare periode waarin er een fors verhoogd risico is op coronairtrombose te overbruggen. Dit wordt duale plaatjesremming genoemd (Engels: dual anti platelet therapy, DAPT). Meestal wordt DAPT gedurende een jaar gegeven. De duur van de DAPT wordt vaak ingekort bij patiënten met een verhoogd bloedingsrisico of patiënten die ook antistolling gebruiken.
- Bètablokker (meestal metoprolol): dient ervoor om de myocardiale zuurstofbehoefte te verlagen. Men streeft na een ACS in principe naar een frequentie van 60-70/min. Uit grote onderzoeken blijkt namelijk dat patiënten met deze hartfrequentie de langste overleving hebben. Het starten van een bètablokker moet niettemin weloverwogen gebeuren. Indien een patiënt hypotensief of gedecompenseerd is, moet de bètablokker later worden gestart.
- Statine (meestal simvastatine): dient als secundaire preventie.
- ACE-remmer (meestal perindopril): heeft een gunstig effect op remodellering van het hart na een infarct en verlaagt de arteriële bloeddruk.
- Eventueel een maagbeschermer (PPI, zoals pantoprazol): wordt standaard gestart bij patiënten > 65 jaar oud die bloedverdunners krijgen, of bij jongere patiënten die een verhoogde kwetsbaarheid hebben voor gastrointestinale bloedingen.
